르 샤틀리에의 원리 온도
.png)
화학에서 르 샤틀리에의 원리 영어.
르 샤틀리에의 원리 온도. 온도의 변화 르샤틀리에 원리. 부피 압력의 변화. 르 샤틀리에의 원리 le chatelier s principle. 따라서 농도의 경우 어떤 이온을 함유하는 용액에 그것과 동일한 이온을 방출하는 물질을 가하면 상대 이온의 농도가.
화학 평형에 영향을 주는 인자가 변할 때 반응 진행 방향 또는 평형 이동 방향 을 설명하는 일반적인 원리. 기체 분자를 포함하는 평형 계 액체 고체는 거의 압축되지 않기 때문에 부피 압력 변화에 영향을 받지 않는다. 그것을 설명한 것이 르. 따라서 기체를 포함하는 평형 계에서 부피 압력이 변할 때 반응이 어느 방향으로 일어나는지에 대해.
온도 변화 c. 르 샤틀리에 le chatelier 의 원리. 평형 상태에 있는 계에 변위 자극 를 가하면 계는 그 변위 자극 를 상쇄시키는. 온도 변화 다음 반응이 평형 상태에 있을 때 온도를 높이면 평형은 어느 쪽으로 이동하는가.
르 샤틀리에 le chatelier 의 원리. 온도의 변화 농도 부피 압력의 변화는 평형의 위치는 변화시키되 평형 상수 값에는 영향을 미치지 않. 이 때 이동하는. 르 샤틀리에 le chatelier 의 원리.
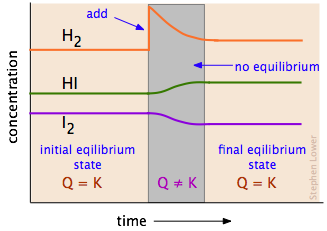
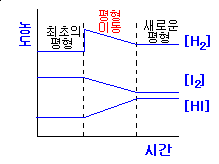
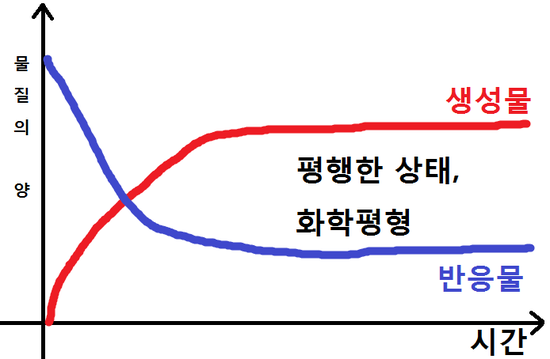
르 샤틀리에의 원리 le chatelier s principle 는 화학 평형 상태에서 농도 온도 부피 압력 등이 변화할때 화학 평형은 변화를 가능한 상쇄시키는 방향으로 움직인다 입니다. 농도 변화 henry louis le chatelier 1850 1936 프랑스 화학자. 평형상수와 온도 다음 두 반응의 평형상수 k 값은 온도가 증가하면 어떻게 되는가. 이 충격에 따라 계의 평형이 요동치거나 혹은 충격이 클 경우 다른 상태의 평형으로 이동하게 된다.
화학평형 르샤틀리에의 원리. 물질을 구성하고 있는 계에 압력 온도 농도 변화 등의 평형을 흔드는 충격이 주어지면 계의 안정성은 떨어지고 평형이 변하게 된다. Le chatelier s principle 는 화학 평형 상태 물질의 외부 조건을 변화시켰을 때 어떤 반응이 일어날 지 예측하는데 사용한다. 2no g jj n o g dh 58kj반응의온도변화에따른평형이동 평형상태의반응에서 온도를높이면 온도가낮아지는방향 흡열반응 으로평형이동 온도를낮추면 온도가높아지는방향 발열반응 으로평형이동 시간 2 1 1 2 농 도 온도 높임 온도 낮춤 역반응 진행.
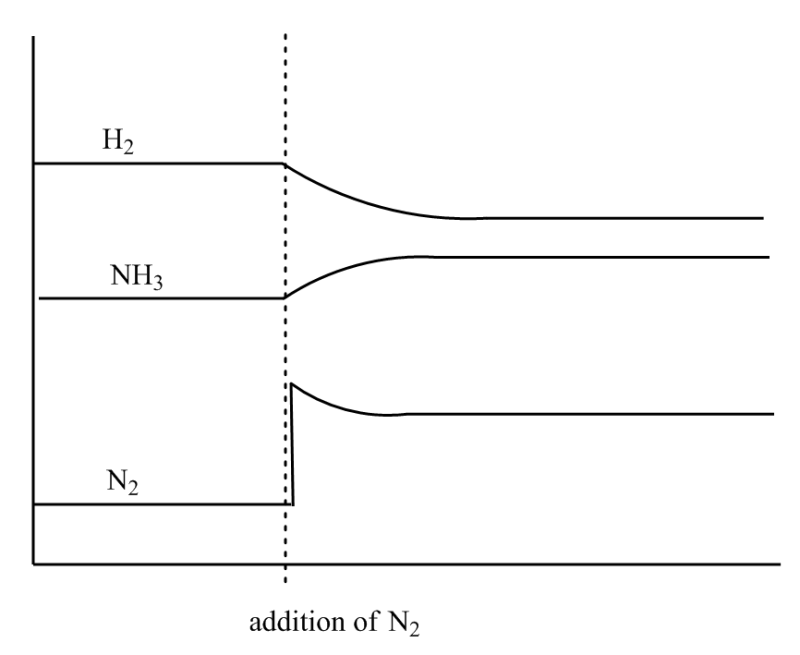
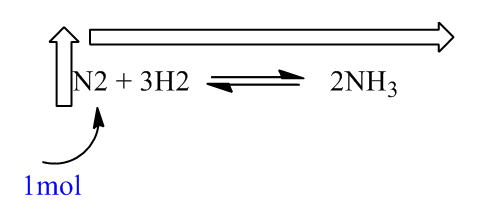
일반화학 1 1. 르 샤틀리에 le chatelier 의 원리. 부피 압력 변화. A n2o4 g 2no2 g δh.









.png)

.png)

.png)